یک پروتئین سمی منافذ پویا را در غشای سلولهای مغزی ایجاد می کند – و این می تواند کلید درک چگونگی رشد بیماری پارکینسون باشد. این نتیجه یک مطالعه جدید از دانشگاه آرهوس است ، جایی که محققان یک روش پیشرفته برای نظارت بر حملات مولکولی در زمان واقعی تهیه کرده اند.
بیماری پارکینسون معمولاً با فیض آغاز می شود. یک لرزش جزئی در دست. کمی سختی با این حال ، با گذشت زمان ، سلولهای مغزی شروع به مرگ می کنند و علائم بدتر می شوند. دلیل این امر برای مدت طولانی یک رمز و راز باقی مانده است – اما دانشمندان اکنون می توانند یک قدم به توضیح نزدیکتر باشند.
در مرکز توجه ، پروتئین A-siglein ، که در ارتباط سلول سلولی در مغز سالم نقش دارد ، دارای A-Sinuclein است. با این حال ، در پارکینسون ، او شروع به رفتار غیر طبیعی می کند و آن را در ساختارهای سمی جمع می کند.
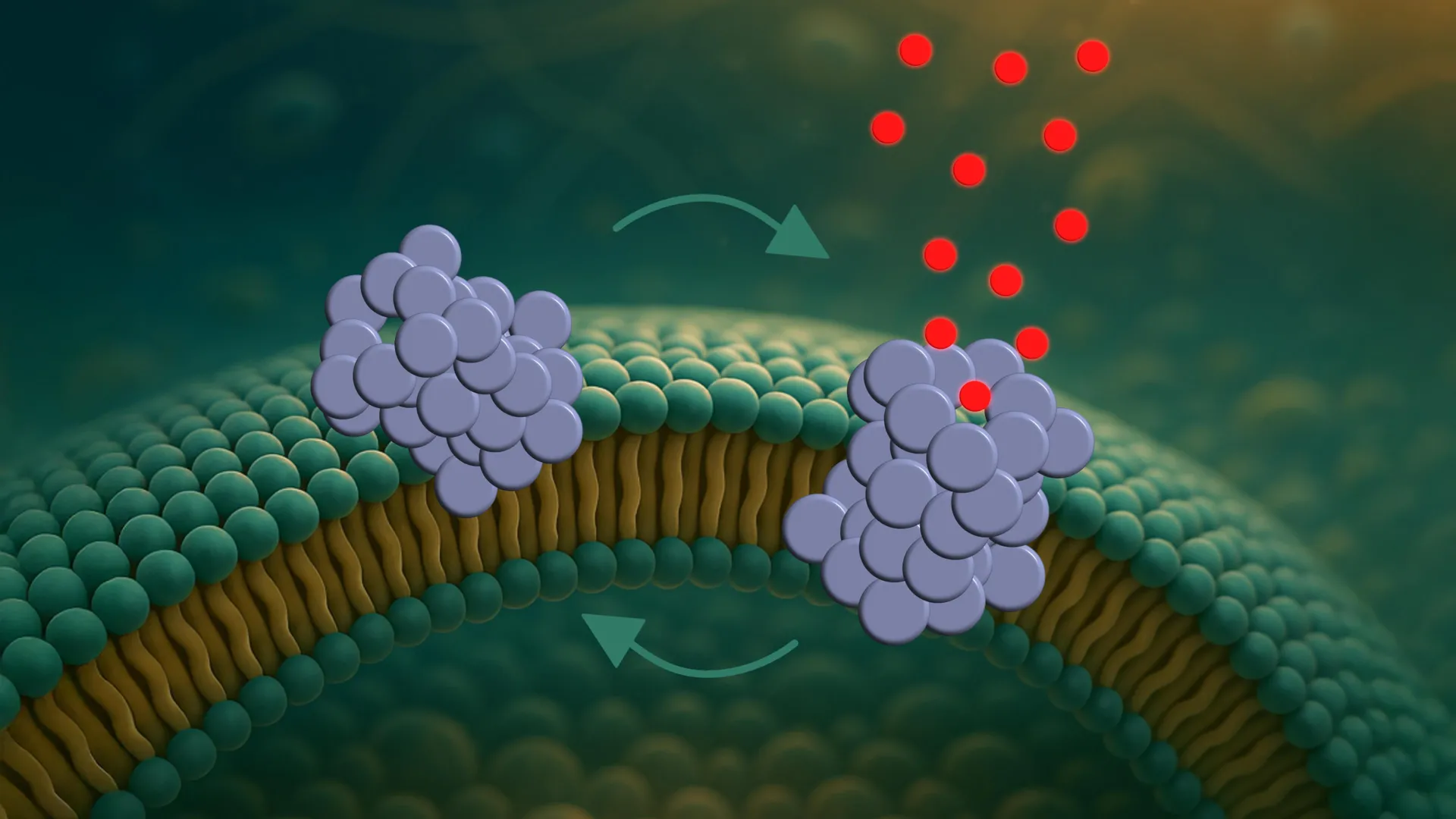
تاکنون ، بیشتر مطالعات بر روی مصالح بزرگی که به عنوان فیبریل شناخته می شوند ، متمرکز شده اند ، که می توان در بافت مغز از بیماران پارکینسون مشاهده کرد. با این حال ، یک مطالعه جدید بر ساختارهای کوچکتر ، کمتر درک شده و سمی تر متمرکز شده است: الیگومرهای A-sinuclein. به گفته محققان ، این کسانی هستند که در غشای سلولهای عصبی سوراخ های میکروسکوپی ایجاد می کنند.
این مطالعه به تازگی در مجله معتبر منتشر شده است AC Nanoمنتشر شده توسط انجمن شیمیایی آمریکا.
درهای اهدا کننده کوچک در سلول ها
وی می گوید: “ما اولین کسی هستیم که مشاهده می کنیم که چگونه این الیگومرها منافذ ایجاد می کنند و چگونه منافذ به طور مستقیم رفتار می کنند.”
این روند در سه مرحله پدیدار می شود. اول ، الیگومرها به ویژه به مناطق خمیده به غشای متصل می شوند. سپس آنها تا حدی خود را در غشای قرار دادند. سرانجام ، آنها قطبی را تشکیل می دهند که به مولکول ها اجازه می دهد تا از تعادل داخلی سلول عبور کنند و به طور بالقوه سلول را مختل کنند.
اما اینها سوراخ های ایستا نیستند. منافذ به طور مداوم مانند درهای چرخشی کوچک باز و بسته می شوند.
وی می گوید: “این رفتار پویا می تواند به توضیح اینکه چرا سلول ها بلافاصله مرده نیستند ، کمک کند.”
حرکت آهسته فیلم مولکولی
این نوع پویایی منافذ برای اولین بار در زمان واقعی مشاهده شد. این امکان وجود دارد که توسط پلت فرم تجزیه و تحلیل وزیکول تک توسعه یافته ، که محققان را قادر می سازد تعامل بین پروتئین های فردی و وزیکول های فردی را دنبال کنند.
وزیکول ها حباب های مصنوعی کوچکی هستند که از غشاهای سلولی تقلید می کنند و به عنوان مدل های سلولهای واقعی ساده عمل می کنند.
مت گالکگارد مالل گفت: “این مانند تماشای یک فیلم مولکولی در فیلمبرداری آهسته است.” “نه تنها با دیدن آنچه اتفاق افتاده است ، ما همچنین می توانیم آزمایش کنیم که چگونه مولکول های مختلف بر روند تأثیر می گذارند. این باعث می شود این پلت فرم به ابزاری ارزشمند برای اسکن مواد مخدر تبدیل شود.”
راه طولانی برای درمان
در حقیقت ، این تیم نانوبودها – آنتی بادی های کوچک – را برای اتصال این الیگومرها آزمایش کرد. آنها قول امید را به عنوان ابزارهای تشخیصی بسیار انتخابی می دهند. با این حال ، به عنوان یک درمان ، هنوز راهی وجود دارد.
بو وولف بروچنر می گوید: “نانوبودها از تشکیل منافذ جلوگیری نمی کنند.” “اما آنها هنوز هم می توانند در مراحل اولیه بیماری به تشخیص الیگومرها کمک کنند. این بسیار مهم است ، زیرا پارکینسون معمولاً پس از فقط آسیب عصبی مهم تشخیص داده می شود.”
این مطالعه همچنین نشان می دهد که منافذ به طور تصادفی نیستند. آنها تمایل دارند در انواع خاصی از غشای رخ دهند – به ویژه کسانی که شبیه غشای میتوکندری هستند ، که کارخانه های انرژی سلول هستند. این ممکن است نشانگر این باشد که خسارت در آنجا آغاز شده است.
هر بار یک قدم
با این حال ، محققان تأکید می کنند که این مطالعه در سیستم های مدل انجام می شود ، نه در سلولهای زنده. مرحله بعدی بازتولید یافته های موجود در بافت بیولوژیکی است که عوامل پیچیده تری در آن فعال می شوند.
“ما یک نصب آزمایش تمیز ایجاد کرده ایم که می توانیم هر بار چیزی را اندازه گیری کنیم. این پلتفرم قدرت این پلتفرم است.” “اما اکنون ما باید قدم بعدی را برداریم و آنچه را که در سیستم های بیولوژیکی پیچیده تر اتفاق می افتد بررسی کنیم.”