هدف دیرینه ایمونوتراپی ها و تحقیقات واکسن القای آنتی بادی در انسان است که ویروس های کشنده ای مانند HIV و آنفولانزا را خنثی می کند. آنتیبادیهایی که «عموماً خنثیکننده» هستند، جالب توجه هستند. این بدان معنی است که در اصل، آنها می توانند چندین گونه از ویروسی مانند HIV را که به سرعت جهش می یابد تا از سیستم ایمنی بدن انسان دور شود، از بین ببرند.
محققان MIT و موسسه تحقیقاتی اسکریپس واکسنی ساخته اند که جمعیت قابل توجهی از سلول های پیش ساز نادر B را ایجاد می کند که می توانند برای تولید آنتی بادی های خنثی کننده گسترده تکامل یابند. گسترش این سلول ها اولین گام به سوی یک واکسن موفق HIV است.
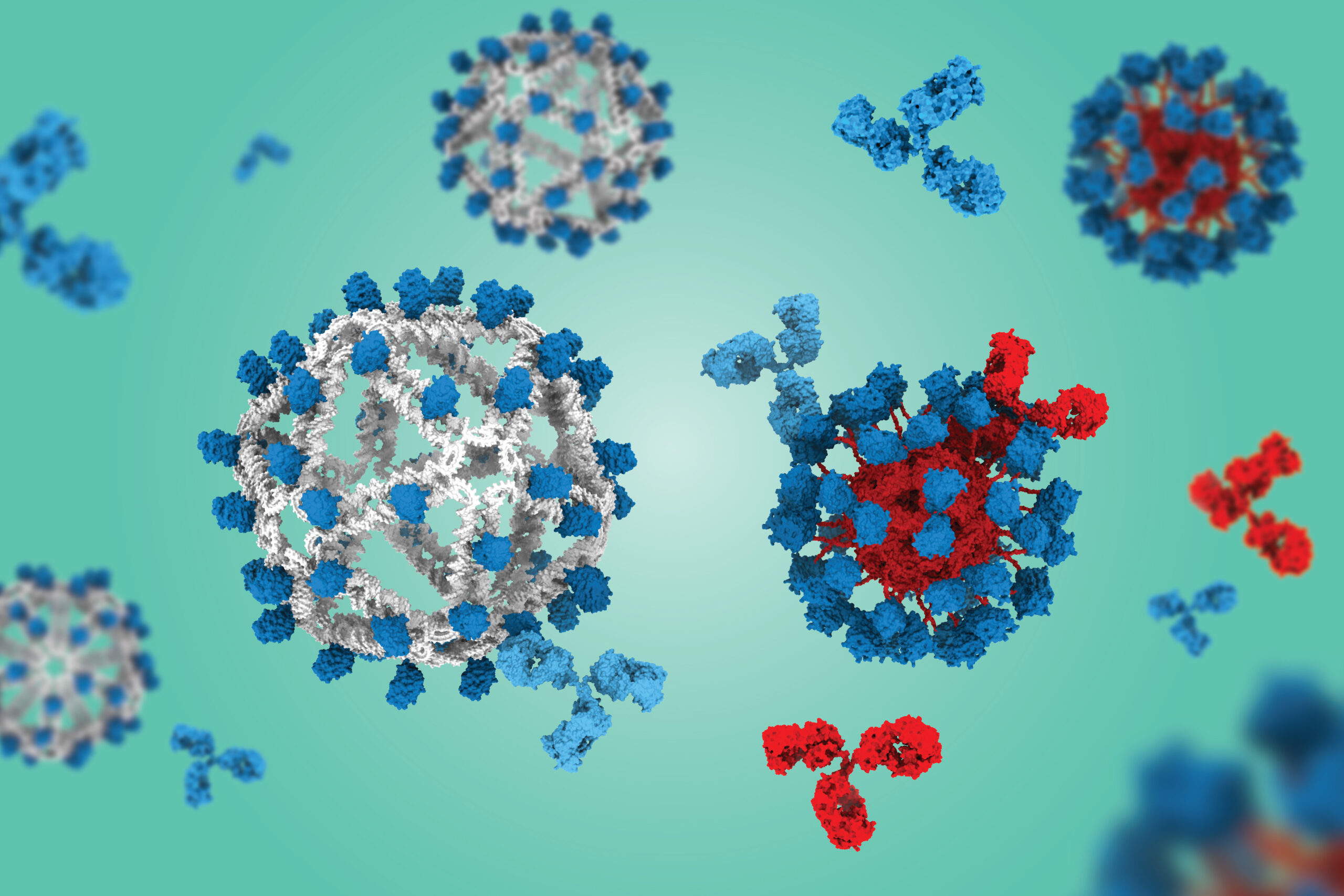
طراحی واکسن محققان از DNA به جای پروتئین به عنوان داربست برای تولید یک ذره ویروس مانند (VLP) استفاده می کند که کپی های متعددی از ایمونوژن مهندسی شده HIV به نام eOD-GT8 را که در اسکریپس ساخته شده است، نمایش می دهد. این واکسن سلولهای پیشساز B بهطور قابلتوجهی در یک مدل موش انسانی در مقایسه با یک ذره ویروسمانند مبتنی بر پروتئین تولید کرد که موفقیت چشمگیری در آزمایشهای بالینی انسانی نشان داده است.
مطالعات پیش بالینی نشان داد که DNA-VLP هشت برابر بیشتر از محصول بالینی سلول های B مورد نظر یا “هدفمند” تولید می کند، که قبلاً نشان داده شده بود که بسیار قوی است.
مارک باث، استاد مهندسی بیولوژیک MIT و عضو وابسته موسسه Broad MIT و هاروارد می گوید: «همه ما شگفت زده شدیم که این VLP برجسته اسکریپس به طور قابل توجهی بهتر از VLP مبتنی بر DNA عمل کرد. این نتایج اولیه بالینی، پیشرفت بالقوهای را به عنوان یک VLP کاملاً جدید و درجه یک نشان میدهد که میتواند طرز تفکر ما را در مورد ایمنیدرمانیهای فعال و طراحی واکسن در نشانههای مختلف تغییر دهد.»
محققان همچنین نشان دادند که داربست DNA وقتی روی آنتی ژن مهندسی شده HIV اعمال می شود، پاسخ ایمنی را القا نمی کند. این بدان معنی است که DNA VLP می تواند برای تحویل آنتی ژن های متعدد در زمانی که استراتژی های تقویتی مورد نیاز است، مانند بیماری های چالش برانگیز مانند HIV، استفاده شود.
دارل اروین، استاد ایمونولوژی و میکروبیولوژی در موسسه تحقیقاتی اسکریپس و محقق موسسه پزشکی هاوارد هیوز میگوید: «DNA-VLP به ما این امکان را داد که برای اولین بار ارزیابی کنیم که آیا سلولهای B هدفدار VLP، توسعه پاسخهای سلول B «در هدف» را محدود میکند یا خیر.
بات و ارواین نویسندگان ارشد این مطالعه هستند. امروز به نظر می رسد علم. نویسنده اصلی مقاله آنا رومانوف دکترای سال ۲۵ است.
آماده سازی سلول های B
مطالعه جدید بخشی از یک تلاش جهانی در حال انجام بزرگ برای توسعه ایمنی درمانی فعال و واکسن هایی است که دودمان خاصی از سلول های B را گسترش می دهد. همه انسان ها دارای ژن های لازم برای تولید سلول های B صحیح هستند که می توانند HIV را خنثی کنند، اما اینها بسیار نادر هستند و به طور کلی برای خنثی شدن به جهش های زیادی نیاز دارند. با این حال، اگر این سلول ها در معرض سری صحیح آنتی ژن ها قرار گیرند، اصولاً می توانند در نهایت برای تولید آنتی بادی های خنثی کننده مورد نیاز رشد کنند.
در مورد HIV، یکی از این آنتیبادیهای هدف به نام VRC01 توسط محققان مؤسسه ملی بهداشت در سال ۲۰۱۰ در حین مطالعه روی افراد مبتلا به HIV که به ایدز مبتلا نشده بودند، کشف شد. این یک تلاش گسترده در سراسر جهان برای ایجاد واکسن HIV که این آنتی بادی هدف را القا می کند، آغاز کرد، اما این یک چالش فوق العاده باقی می ماند.
اعتقاد بر این است که تولید آنتیبادیهای خنثیکننده HIV به سه مرحله واکسیناسیون نیاز دارد که هر مرحله توسط آنتیژن متفاوتی آغاز میشود که به هدایت تکامل سلولهای B به سمت هدف صحیح، پروتئین بومی پوشش HIV gp120 کمک میکند.
در سال ۲۰۱۳، ویلیام شیف، استاد ایمونولوژی و میکروبیولوژی در اسکریپس، آنتی ژن مهندسی شده ای به نام eOD-GT6 را گزارش کرد که می تواند برای اولین مرحله در این فرآیند، به نام پرایمینگ، مورد استفاده قرار گیرد. سپس تیم او آنتی ژن را به eOD-GT8 ارتقا داد. واکسیناسیون با eOD-GT8 توالی یابی شده روی پروتئین VLP، پیش سازهای آنتی بادی اولیه VRC01 را در موش ها و اخیراً در انسان تولید کرد. این اولین قدم مهم به سمت واکسن HIV است.
با این حال، پروتئین VLP همچنین مقدار قابلتوجهی از آنتیبادیهای «خارج از هدف» تولید میکند که به خود پروتئین نامربوط و بالقوه حواسپرتی VLP متصل میشود. این ممکن است پیامدهای ناشناخته ای بر تکثیر سلول های B هدف مورد علاقه برای HIV و همچنین سایر برنامه های کاربردی چالش برانگیز ایمونوتراپی داشته باشد.
آزمایشگاه های Bathe و Irvine شروع به آزمایش کردند که آیا می توانند از ذره ای ساخته شده از DNA به جای پروتئین برای تحویل آنتی ژن اولیه استفاده کنند یا خیر. این ذرات در مقیاس نانو با استفاده از اریگامی DNA ساخته شده اند، روشی که کنترل دقیقی بر ساختار DNA مصنوعی ارائه می دهد و به محققان اجازه می دهد تا آنتی ژن های ویروسی را به مکان های خاص متصل کنند.
در سال ۲۰۲۴، بات و دانیل لینگوود، دانشیار دانشکده پزشکی هاروارد و محقق اصلی در موسسه راگون، نشان دادند که این DNA VLP میتواند برای تحویل واکسن SARS-CoV-2 به موشها برای تولید آنتیبادیهای خنثیکننده استفاده شود. از این مطالعه، محققان دریافتند که داربست DNA، برخلاف پروتئینها، آنتیبادیهایی را علیه خود VLP تحریک نمیکند. آنها متعجب بودند که آیا این امکان پاسخ آنتی بادی متمرکز تری را نیز فراهم می کند.
بر اساس این نتایج، رومانوف، با نظارت مشترک Bathe و Irvine، شروع به اعمال DNA VLP در واکسن پرایمینگ HIV Scripps بر اساس eOD-GT8 کرد.
“مطالعه قبلی ما روی آنتی ژن های SARS-CoV-2 روی DNA-VLP ها نشان داد که DNA-VLP ها می توانند برای متمرکز کردن پاسخ ایمنی بر روی یک آنتی ژن مورد نظر استفاده شوند. این ویژگی به ویژه برای موردی مانند HIV مفید به نظر می رسد، جایی که سلول های B مورد علاقه بسیار نادر هستند. بنابراین، ما فرض کردیم که کاهش رقابت بین سایر سلول های B نامرتبط می تواند به افزایش nanoi DNA سلول های B کمک کند. رومانوف می گوید شانس زنده ماندن این سلول های نادر.
اما مطالعات اولیه بر روی موش ها نشان داد که واکسن پاسخ اولیه سلول B کافی به اولین دوز اولیه را تحریک نمی کند.
پس از طراحی مجدد DNA VLP ها، رومانوف و همکارانش دریافتند که نسخه با قطر کمتر با ۶۰ به جای ۳۰ نسخه از آنتی ژن مهندسی شده به طور قابل توجهی از ساختار پروتئین بالینی VLP، هم از نظر تعداد کلی سلول های B اختصاصی آنتی ژن و هم از نظر کسری از سلول های B که برای مکان خاص HIV مورد نظر هدف قرار می گیرند، بهتر عمل می کند. این نتیجه حفظ بهتر ذرات در فولیکول های سلول B در غدد لنفاوی و همکاری بهتر با سلول های T کمک کننده بود که بقای سلول های B را افزایش می دهد.
به طور کلی، این پیشرفت ها ذرات را قادر می سازد تا هشت برابر بیشتر از واکسن حاوی eOD-GT8 که توسط داربست پروتئینی حمل می شود، سلول های B هدفمند تولید کنند. یافته مهم دیگری که توسط آزمایشگاه لینگوود توصیف شد این بود که قطعات DNA سلولهای B پیشساز VRC01 را بهطور مؤثرتری نسبت به پروتئین VLP به سمت آنتیبادی VRC01 تحریک کردند.
شیف، که همچنین معاون طراحی پروتئین در Moderna است، میگوید: «در زمینه ایمونولوژی واکسن، این سؤال که آیا پاسخهای سلول B به اپی توپ محافظ هدفمند روی آنتیژن واکسن توسط پاسخها به اپی توپهای خارج از هدف مجاور روی همان آنتیژن مهار میشود یا خیر، تحت بررسی شدید است». برخی دادهها از مطالعات دیگر وجود دارد که نشان میدهد پاسخهای خارج از هدف ممکن است تأثیر زیادی نداشته باشند، اما این مطالعه کاملاً متقاعدکننده نشان میدهد که کاهش پاسخهای خارج از هدف با استفاده از DNA VLP میتواند پاسخهای روی هدف مورد نظر را بهبود بخشد.»
گابریل ویکتورا، پروفسور ایمونولوژی، ویروس شناسی و میکروبیولوژی دانشگاه راک افلر که در پژوهشی در دانشگاه راکف و ویروس شناسی و میکروبیولوژی دخیل نبود، می گوید: «در حالی که فرمول های نانوذرات در تقویت پاسخ های آنتی بادی در برابر انواع آنتی ژن ها عالی هستند، همیشه این سوال آزاردهنده وجود دارد که آیا رقابت از سوی سلول های B خاص برای آنتی ژن های ساختاری خود ذره، پاسخ های آنتی بادی را در برابر اپی توپ های هدف غلبه خواهد کرد یا خیر. ذرات مبتنی بر DNA که تحمل طبیعی سلول های B را در برابر اسیدهای نوکلئیک افزایش می دهند، ایده ای هوشمندانه برای غلبه بر این مشکل است و آزمایش های ظریف تیم تحقیقاتی به وضوح نشان می دهد که این استراتژی می تواند برای تسهیل هدف گیری اپی توپ های دشوار مورد استفاده قرار گیرد.
یک اسکله “آرام”.
این واقعیت که داربست DNA-VLP آنتیبادیهای مخصوص داربست را القا نمیکند به این معنی است که میتوان از آن برای حمل دومین و بالقوه سوم آنتیژن مورد نیاز در سری واکسنها استفاده کرد، همانطور که محققان در حال حاضر در حال بررسی هستند. همچنین ممکن است آنتیبادیهای هدفمند بهبود یافته قابلتوجهی را برای تعداد زیادی از آنتیژنهایی که تحت سلطه هستند و قادر به رقابت با داربستهای پروتئینی VLP غیرمرتبط در این یا سایر کاربردها نیستند، ارائه دهد.
بات میگوید: «پیشرفت این مقاله، اندازهگیری دقیق و مکانیکی کمی است که چگونه DNA-VLPها میتوانند پاسخهای آنتیبادی را روی آنتیژنهای مورد نظر متمرکز کنند، که نتیجه ماهیت خاموش این داربست مبتنی بر DNA است که قبلا نشان دادهایم در سیستم ایمنی نهفته است».
به طور کلی تر، محققان پیشنهاد می کنند که این نوع جدید VLP می تواند برای تولید انواع دیگر پاسخ های آنتی بادی محافظ در برابر تهدیدات همه گیر مانند آنفولانزا یا عوامل بالقوه جنگ شیمیایی مورد استفاده قرار گیرد. روش دیگر، میتواند به عنوان یک ایمونوتراپی فعال برای تولید آنتیبادیهایی استفاده شود که آمیلوئید بتا یا پروتئین تاو را برای درمان بیماریهای دژنراتیو مانند آلزایمر مورد هدف قرار میدهند، یا برای تولید آنتیبادیهایی که مواد شیمیایی مضر مانند مواد افیونی یا نیکوتین را هدف قرار میدهند تا به افراد مبتلا به اعتیاد کمک کنند.
این تحقیق توسط مؤسسه ملی بهداشت تأمین مالی شد. موسسه راگون MGH، MIT و هاروارد. موسسه پزشکی هوارد هیوز؛ بنیاد ملی علوم؛ بنیاد نوو نوردیسک؛ کمک هزینه تحصیلی (هسته ای) موسسه کوخ از موسسه ملی سرطان؛ موسسه ملی علوم بهداشت محیطی؛ همکاری بنیاد گیتس برای کشف واکسن ایدز؛ مرکز آنتی بادی خنثی کننده IAVI. موسسه ملی آلرژی و بیماری های عفونی؛ و دفتر تحقیقات ارتش ایالات متحده از طریق مؤسسه نانوتکنولوژی سربازان MIT.